来源于:奇点糕 奇点网
心肌梗死简称心梗,是导致人类死亡的主要原因之一,目前仍是一种无法完全治愈的疾病。
从字面意思上看,心肌梗死就是向心肌组织供血的血管堵塞导致心肌细胞死亡,看上去似乎没那么复杂,但是想阻止心肌细胞死亡却并没有那么简单。
近日有个好消息,河南大学抗体药物开发技术国家地方联合工程实验室马远方教授团队,在著名期刊《科学·转化医学》上发表重要研究成果[1]。
他们发现,肿瘤坏死因子相关的凋亡诱导配体(TRAIL)与死亡受体5(DR5)结合,会诱导心肌细胞死亡,并募集和活化白细胞,进而导致心脏损伤。

此外,他们还首次在多种动物模型中证实,用可溶性DR5-Fc融合蛋白(sDR5-Fc),可阻断体内TRAIL与DR5结合,减少心肌梗死后的心肌细胞死亡与炎症反应并改善心脏功能。
河南大学的王耀辉副教授为论文第一作者,张海龙、王志增、魏寅祥博士为共同第一作者;马远方教授和宾夕法尼亚大学陈有海教授为论文共同通讯作者。

▲ 论文千亿体育·(中国)手机网页版,截图
心血管疾病起病突然、疾病进展速度极快,致死率高,是比肿瘤更为可怕的人类健康杀手。
稍有医学常识的人都知道,急性心梗是猝死的主要原因,目前,最有效的治疗方法是发病后,在黄金档口期内尽快进行经皮冠状动脉介入(PCI)手术,放置支架。
但是,在冠状动脉堵塞后,缺血区心肌细胞以每小时20%的速度死亡,目前能在2个小时的黄金救治期内完成PCI手术的病人少之又少。这就需要寻找一种有效的方法,尽量延缓心肌细胞死亡的速度,以给医生和患者争取宝贵的治疗时间。
之前的研究表明,在心梗的时候,受损的心肌或驻留的免疫细胞会释放的趋化因子,将循环白细胞募集到损伤部位[2,3]。这些被招募过来的免疫细胞被激活之后,会加重梗塞组织中的炎症反应[4]。
因此,抗炎治疗可能有助于控制心梗期间的组织损伤。实际上,目前已经有一些针对炎症因子的临床前和临床研究在展开了[5-7],并且已经取得了不错的效果。不过,从抗炎的角度出发的话,究竟到什么程度能减少心肌损伤仍未可知[8]。
马远方教授团队注意到,sDR5是预测急性心梗患者长期全因死亡率最有力的生物标志物之一[9],蛋白质组分析也显示sDR5与收缩性心力衰竭密切相关;此外,血液中TRAIL的浓度还与患者心梗的严重程度和预后相关[11]。
以上研究都表明,DR5和TRAIL都与心梗密切相关,但二者在心梗中究竟起什么作用,仍未可知。于是DR5和TRAIL就成了马远方教授团队的研究对象。
马远方教授团队首先在心梗模型动物证实,心梗确实会导致DR5高表达。于是,他们假设DR5-TRAIL通路参与了心肌损伤过程,阻断DR5与TRAIL的结合,有可能改善心梗的病理进程。
为了验证这个假设,他们设计了一种可溶性DR5-抗体重链恒定区融合蛋白(sDR5-Fc),实验数据显示,sDR5-Fc可以与鼠、猴和人的TRAIL结合,且亲和力随种属接近于人而增高。在Jurkat细胞系中的凋亡阻断实验结果表明,sDR5-Fc以剂量依赖性方式阻断TRAIL诱导的凋亡。这表明sDR5-Fc可以有效阻断DR5-TRAIL通路。
那sDR5-Fc在模型动物体内的效果如何呢?
结果还是非常喜人的:sDR5-Fc可减少大鼠心肌梗死面积41%,减少小型猪心肌梗死面积67%,减少恒河猴心肌梗死面积76%。此外,给心梗的大鼠及恒河猴单次注射sDR5-Fc,均显著提高后期心功能,防止心衰发生。
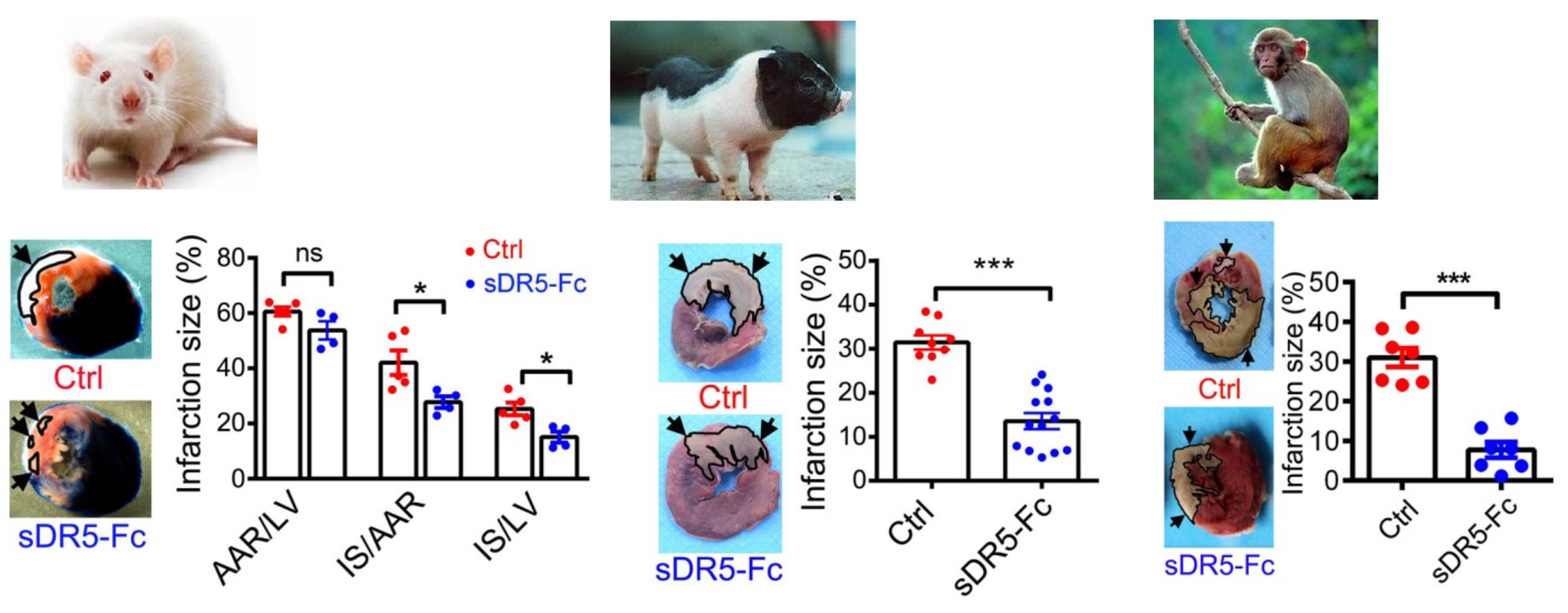
▲ sDR5-Fc对大鼠、小型猪和恒河猴心肌的保护作用
还有一个更重要的数据是,sDR5-Fc单次静脉用药可将恒河猴心梗模型的黄金救治期延长120分钟(据马远方教授透露,他们最新数据显示可以延长180分钟)。如果这个效果能在人体得到验证的话,那就相当于将救治的黄金窗口期从原来的2小时,延长到5小时,必将会挽回更多患者的生命。
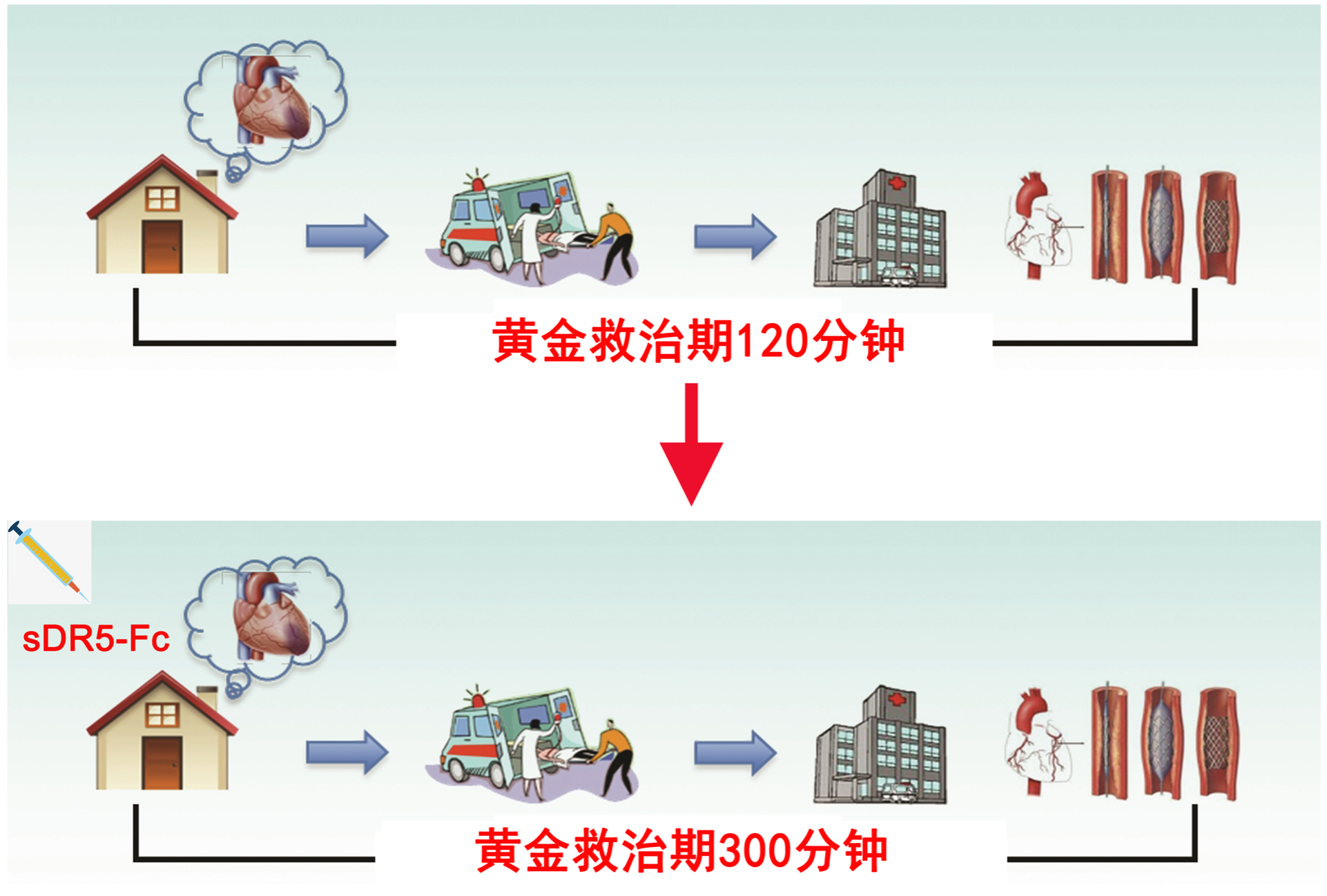
▲ sDR5-Fc延长黄金救治期
在后续的研究中,马远方教授团队又进一步揭示了DR5-TRAIL参与心肌损伤的机制。他们发现,在缺氧的情况下,DR5-TRAIL通路一方面直接导致心肌细胞死亡,另一方面募集并活化炎性细胞,产生大量促炎细胞因子,加重心肌细胞凋亡。
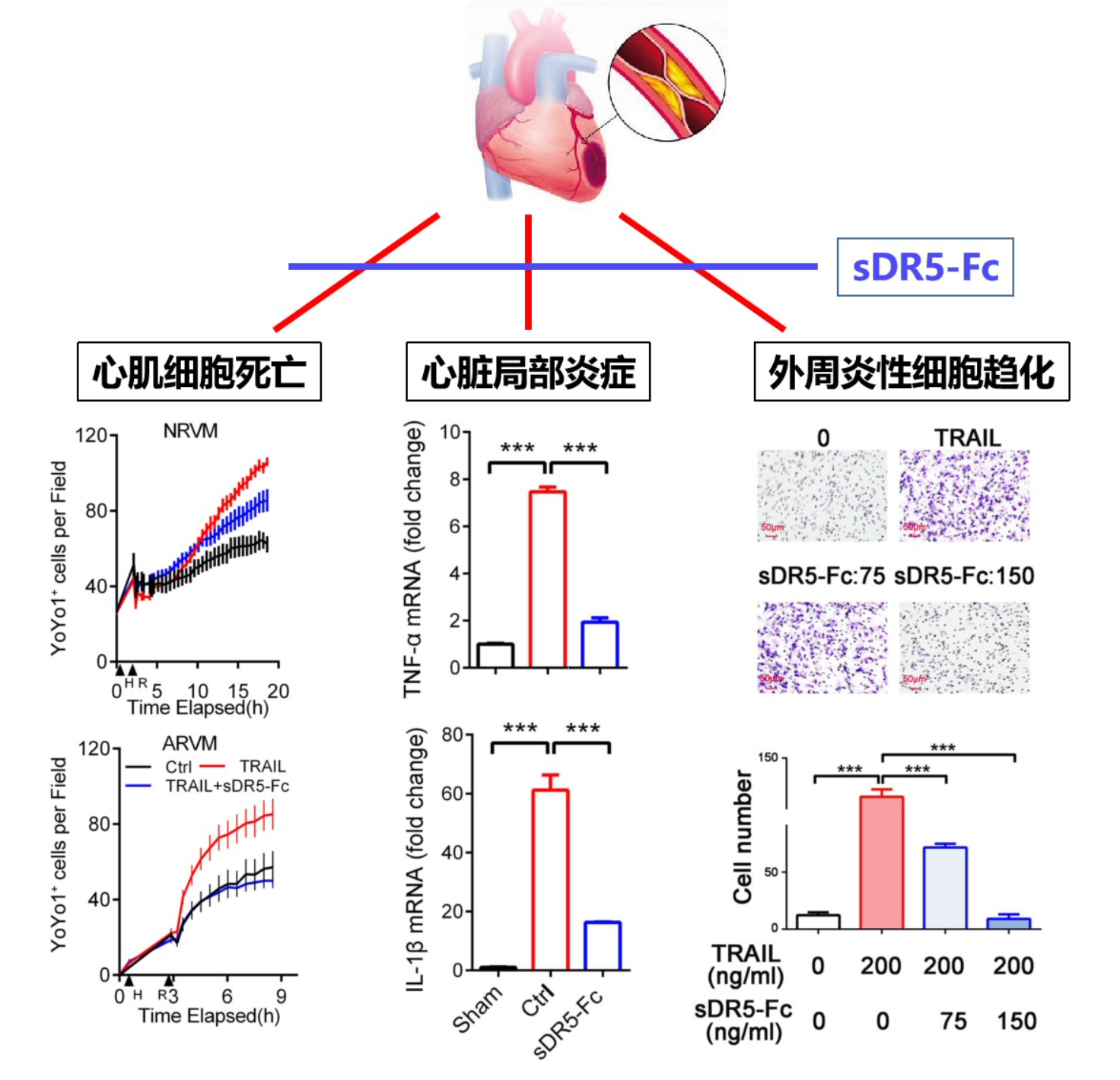
▲ sDR5-Fc心肌保护作用机制
据了解,马远方教授团队的研究成果已获批2项国家发明专利,1项PCT专利正在申请中。他们正在开展sDR5-Fc的临床前研究。
期待马远方教授的研究成果早日转化到临床,以挽救更多心梗患者的生命。
参考资料:
[1].Wang Y, Zhang H, Wang Z, et al. Blocking the death checkpoint protein TRAIL improves cardiac function after myocardial infarction in monkeys, pigs, and rats[J]. Science Translational Medicine, 2020, 12(540).
[2].Frangogiannis N G. Pathophysiology of myocardial infarction[J]. Comprehensive Physiology, 2011, 5(4): 1841-1875.
[3].Yan X, Anzai A, Katsumata Y, et al. Temporal dynamics of cardiac immune cell accumulation following acute myocardial infarction[J]. Journal of molecular and cellular cardiology, 2013, 62: 24-35.
[4].Bonaventura A, Montecucco F, Dallegri F. Cellular recruitment in myocardial ischaemia/reperfusion injury[J]. European journal of clinical investigation, 2016, 46(6): 590-601.
[5].Hayashidani S, Tsutsui H, Shiomi T, et al. Anti-monocyte chemoattractant protein-1 gene therapy attenuates left ventricular remodeling and failure after experimental myocardial infarction[J]. Circulation, 2003, 108(17): 2134-2140.
[6].Ridker P M, MacFadyen J G, Everett B M, et al. Relationship of C-reactive protein reduction to cardiovascular event reduction following treatment with canakinumab: a secondary analysis from the CANTOS randomised controlled trial[J]. The Lancet, 2018, 391(10118): 319-328.
[7].Ridker P M, Everett B M, Thuren T, et al. Antiinflammatory therapy with canakinumab for atherosclerotic disease[J]. New England journal of medicine, 2017, 377(12): 1119-1131.
[8].Huet F, Akodad M, Fauconnier J, et al. Anti-inflammatory drugs as promising cardiovascular treatments[J]. Expert review of cardiovascular therapy, 2017, 15(2): 109-125.
[9].Skau E, Henriksen E, Wagner P, et al. GDF-15 and TRAIL-R2 are powerful predictors of long-term mortality in patients with acute myocardial infarction[J]. European journal of preventive cardiology, 2017, 24(15): 1576-1583.
[10].Stenemo M, Nowak C, Byberg L, et al. Circulating proteins as predictors of incident heart failure in the elderly[J]. European journal of heart failure, 2018, 20(1): 55-62.
[11].Nakajima H, Yanase N, Oshima K, et al. Enhanced expression of the apoptosis inducing ligand TRAIL in mononuclear cells after myocardial infarction[J]. Japanese heart journal, 2003, 44(6): 833-844.


